| 来源:中科院 | 2022-04-18 15:31:45 |
在生物进化过程中,人类为了更好地适应自身生活的环境,进化出了包括听觉、视觉、嗅觉、触觉、味觉、痛觉、痒觉等多种感觉系统。由于感觉系统是人类感知外界的基本反应,也是生物体与外界交流及自我保护的基础,因此关于感觉系统的探索长期以来是科学家的研究热点。
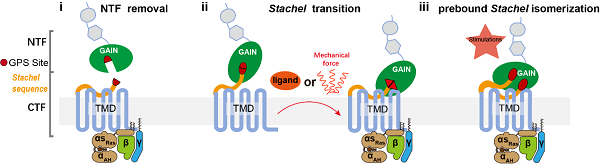
中国科学院上海药物研究所徐华强课题组和山东大学孙金鹏课题组长期致力于与感觉相关的GPCR受体的研究。徐华强课题组解析了视杆色素和Arrestin吗,G蛋白和GRK地复合物结构,以及视觉感知的基础。孙金鹏课题组则发表了与听觉相关的受体VLGR1的研究成果,以及痒觉受体MGPRX2的研究。虽然近些年来研究黏附类GPCR与机械力的作用关系已取得一定成果,但黏附类受体感知机械力的作用机制尚不清晰。
4月13日,上海药物所徐华强团队联合山东大学孙金鹏团队以及德国Rudolf Schonheimer生物化学研究所Ines Liebscher团队,共同在Nature在线发表了题为Structural basis for the tethered peptide activation of adhesion GPCRs的最新研究成果,解析了感知机械力的黏附类受体GPR133、GPR114与下游蛋白Gs的复合物电镜结构,证明了受体感知机械力后通过Stachel序列激活受体,阐明了受体对Stachel序列(tethered peptide)的识别与受体自激活的机制。
“力”能决定细胞命运,生命体对力的感知十分重要,机械力刺激驱动许多生理过程,包括触觉、痛觉、听觉和平衡调节。在细胞生物学的发展过程中,人们逐渐意识到细胞可以感知机械外力传递的信号并做出多种生理变化,机械外力对于细胞的动态以及机体的正常生长运行十分重要。例如,耳对风力的感知,肺对气体压入的感知,皮肤细胞对按压力的感知,这些生理过程均与机械力的感知密不可分。其中一些特化的细胞进化成为专门感知机械力的“终端”,如触觉受体Piezo家族蛋白能够感知机械力,听觉相关受体TMC在耳蜗毛细胞中通过机械力介导听觉传导,这些是普遍认知的能够感知机械力的离子通道受体。GPCR作为另一大类膜受体也能感知机械力,其对力的感知大多通过黏附类受体家族进行,如GPR114、GPR133、GPR126、GPR56等,这缘于其独特的结构和功能特征。黏附类受体(aGPCR)具有巨大的含有众多结构域的胞外端,胞外端参与受体与受体以及受体与细胞基质间的相互作用,它与机械力的感知密切相关,然而黏附类受体感知机械力后如何激活并进行信号转导尚不清楚。
黏附类受体另一个显著的结构特征是含有GAIN(GPCR autoproteolysis-inducing)结构域和GPS(GPCR proteolytic site)自水解位点,大多数黏附类受体GPS可以发生自水解反应,将受体切割为NTF(N-terminal fragment)和CTF(C-terminal fragment)两个片段,受体CTF N端大约十几个氨基酸可以作为激动剂将受体激活并招募下游G蛋白,该部分序列称为Stachel序列或栓系激动剂(TA, Tethered agonist)。aGPCR与其他家族GPCR不同的一个重要特征是其能够依赖Stachel序列自激活。前期研究证明了小分子配体可以直接与黏附类受体7次跨膜核心结合并激活受体。但是黏附类受体自激活状态下的作用机制仍不清楚。目前已报道的Stachel序列介导的aGPCR激活至少有三种激活模式(图1):(1)Stachel序列在GPS处自水解后,NTF与CTF解离,Stachel序列暴露,然后与TMD相互作用;(2)Stachel序列与TMD有预结合或间歇的相互作用,该作用通过配体刺激或机械力稳定下来;(3)Stachel序列与TMD接触通过GAIN结构域内部构象变化调节。每个假设均有实验支持,但也相互矛盾。例如,GAIN结构域的晶体结构显示Stachel序列被隐藏为无法与TMD相互作用的β折叠,这与某些能被Stachel序列激活的aGPCRs的高组成活性相冲突。因此Stachel序列如何激活受体尚不清楚。
针对上述两个问题,科研人员以黏附类受体GPR133和GPR114作为模型进行结构分析,探究Stachel序列介导的aGPCR激活机制。GPR133GPS位点发生水解,在质膜上发生NTF-CTF分离。GPR114不发生自水解,能够感知机械力。
Stachel序列可以作为激动剂激活GPR133, GPR114受体,招募下游Gs蛋白。生化实验验证,GPR133/GPR114去掉NTF后本底活性明显高于全长受体以及缺少Stachel序列的CTF结构。通过体外合成受体Stachel序列刺激去掉Stachel序列的CTF片段,同样证明Stachel序列能作为激动剂激活受体。此外,研究发现,机械力通过调控Stachel与受体的结合来激活受体。研究人员对野生型以及GPR133 GPS位点突变(失去自剪切功能)受体分别进行机械力检测,发现均可以感知机械力。研究还发现,将人NTF上的重要位点突变并没有影响其机械力的感知效果,侧面印证了机械力的作用方式是通过NTF的振动构象改变,使Stachel序列暴露,然后与受体进行结合从而激活受体。基于此结果,研究将受体结合口袋中与Stachel相互作用位点进行突变,发现机械力作用有不同程度的降低,因此得出结论——机械力是通过调控Stachel与受体的结合来激活受体(图2)。
通过复合物冷冻电镜结构解析,研究发现了Stachel序列HIM结构介导其与受体相互作用。为探究Stachel序列与受体之间的作用关系,研究人员解析了GPR133-CTF-Gs-Nb35和GPR114-CTF-Gs-scFv16复合物的低温电镜结构,分辨率分别为3.1 埃和3.3 埃(图3a)。GPR133-CTF和GPR114-CTF的总体TMD排列与团队最近解析的黏附受体GPR97结构差别较大,更类似于分泌素样GPCR(ClassB1)结构,在TM6和TM7存在两个kink结构。GPR133-CTF和GPR114-CTF的Stachel序列均折叠在被跨膜螺旋和ECL2包围的正构结合位点口袋内,Stachel序列在口袋内部形成α螺旋结构(图3b)。Stachel序列中5个疏水氨基酸组成的保守HIM (Fss-03xφφφxφss-09)在Stachel序列与受体相互作用中起核心作用(图3c)。Fss-03, φss-06, φss-07三个氨基酸侧链朝向配体结合口袋内侧,φss-05侧链朝向口袋外侧,最后一位φss-09与TM5以及ECL2上的氨基酸形成一个疏水口袋(图3d-i)。
在GPR133-CTF和GPR114-CTF受体中均发现了保守切换开关W6.53,它可以感知Stachel序列的结合,介导受体的激活。Q/Y7.49和保守的N5.50与P6.47/ V6.47φφG6.50基序形成氢键网络,其对稳定TM6和TM7的kink结构十分重要。在kink结构的下方,TM6和TM7末端向外倾斜,形成更大的细胞质空腔,促进与G蛋白偶联。与其他GPCR不同的是,GPR114具有延伸的TM7,扩展TM7插入到Gαs和Gβ1亚基之间产生的凹槽中,延伸螺旋可能在其细胞内信号传导中发挥重要作用。
综上所述,研究人员首先通过功能实验证明了受体感知机械力后通过Stachel序列激活受体,冷冻电镜结构解析进一步确定了Stachel中的5个疏水氨基酸组成的保守HIM (Fss-03xφφφxφss-09)在Stachel序列与受体相互作用中起核心作用,阐明了Stachel序列被受体识别的结构基础,揭示了黏附类受体在机械力作用下依赖Stachel序列激活的激活机制,拓展了对于Stachel序列介导的aGPCR与G蛋白偶联机制的认知,并为Stachel序列外源短肽设计提供了依据。
研究工作得到国家重点研发计划基金、国家杰出青年科学基金、国家优秀青年科学基金、国家自然科学基金委重点基金和山东省优秀青年基金的支持。
责任编辑:techtoutiao